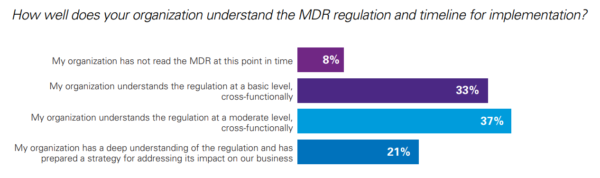
Dans une enquête réalisée conjointement par KPMG et la RASP (Regulatory Affairs Professional Society) auprès de plus de 200 responsables qualité et affaires réglementaires d’entreprises du DM, on apprend que le chemin à parcourir pour assurer la mise en conformité en vue du règlement DM reste conséquent. Les structures interrogées, qui vont de la petite PME au géant international, nous laisse entendre que :
- 78% d’entre elles n’ont pas une compréhension suffisante du règlement DM (il s’agit de l’obstacle le plus important),
- 58% n’ont pas mis de stratégie en place pour remédier aux écarts concernant les données cliniques et le recueil de données post-marché,
- 39% n’ont pas encore identifié, défini ou documenté les rôles et responsabilité de la Personne Responsable de la conformité réglementaire.
Les entreprises interrogées sont conscientes que la notification tardive des organismes notifiés et que leur nombre restreint risque de causer des problèmes d’engorgement courant 2020.
Le rapport conclue sur une bonne nouvelle : il reste encore 18 mois pour planifier les actions de mises en conformité, et sélectionner les produits que l’on souhaite certifier en priorité selon le règlement.
